Insuline
L'insuline (du latin : insula « île ») est une hormone protéique sécrétée par les cellules β des îlots de Langerhans dans le pancréas, ainsi que dans le corps de Brockmann (en) chez certains poissons téléostéens[2]. Elle a un effet important sur le métabolisme des glucides, des lipides et des protéines en favorisant l'absorption du glucose présent dans le sang par les cellules adipeuses, les cellules du foie et celles des muscles squelettiques. Le glucose absorbé par ces tissus est converti en glycogène ou en triglycérides, voire en les deux à la fois dans le cas du foie. La libération de glucose par le foie dans le sang est très fortement limitée par un taux sanguin élevé en insuline[3]. Cette hormone joue de ce fait, avec le glucagon, un rôle majeur dans la régulation des substrats énergétiques, dont les principaux sont le glucose, les acides gras et les corps cétoniques. Dans le couple que forment l'insuline et le glucagon, l'insuline a le rôle principal chez les mammifères : son absence est fatale dans un délai de quelques mois. Dans d'autres espèces, en particulier chez les oiseaux, c'est l'inverse : le glucagon est l'hormone principale.
| Insuline | |
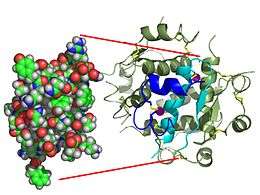 | |
| Monomère d'insuline humaine (PDB 1AI0). | |
| Identification | |
|---|---|
| No CAS | (insuline humaine) |
| No ECHA | 100.031.151 |
| No CE | 232-672-8 234-279-7 (insuline humaine) |
| No RTECS | NM8900250 |
| Code ATC | A10, A10, A10, A10, A10, A10, A10, A10, A10 |
| DrugBank | DB00030 |
| PubChem | 16129672 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule brute | C257H383N65O77S6 [Isomères] |
| Masse molaire[1] | 5 807,57 ± 0,299 g/mol C 53,15 %, H 6,65 %, N 15,68 %, O 21,21 %, S 3,31 %, |
| Propriétés physiques | |
| T° fusion | 81 °C |
| Unités du SI et CNTP, sauf indication contraire. | |

Globalement, l'action de l'insuline est souvent résumée par son effet hypoglycémiant (baisse du taux de glucose dans le sang). Il est probablement plus juste de dire que l'insuline est sécrétée en fonction de l'état nutritionnel et de l'activité physique, de sorte qu'après les repas, sous l'influence de l'élévation de la glycémie (la concentration de glucose dans le sang), mais aussi sous l'influence directe de la présence des aliments dans le tube digestif, la sécrétion d'insuline est stimulée, ce qui permet le stockage du glucose, produit final de la digestion des aliments glucidiques. D'une manière générale, l'insuline sanguine a pour effet de stimuler l'anabolisme des cellules, ce qui en fait une hormone anabolisante ; à l'inverse, une faible concentration en insuline dans le sang favorise le catabolisme, c'est-à-dire la dégradation des macromolécules biologiques en molécules plus petites.
Les diabètes sucrés sont des maladies de la sécrétion d'insuline. Dans sa forme la plus sévère, le diabète insulino-dépendant (ou diabète de type 1) est mortel en quelques mois en l'absence de traitement, dans un tableau caractérisé par l'hyperglycémie, la perte de muscle et de tissu adipeux, et la production massive et non régulée non seulement de glucose mais aussi de corps cétoniques : c'est l'acidocétose diabétique. En Occident, le diabète insulinodépendant est une maladie qui n'est que très rarement fatale, grâce à l'insuline, médicament que les diabétiques doivent s'injecter plusieurs fois par jour. Ce n'est pas le cas dans la plupart des pays de l'Afrique subsahélienne où l'insuline médicament fait souvent défaut.
Les insulines humaines obtenues par génie génétique sont, contrairement aux anciennes insulines prélevées chez le porc, d'une stabilité telle que depuis 2010 beaucoup de patients insulinotraités ne sont pas des patients insulinodépendants : l'usage de l'insuline évite une fatigue à long terme des reins observée avec les médicaments tels que la metformine.
Découverte
Le rôle du pancréas dans la maladie diabétique a été découvert par Oskar von Minkowski[4],[5], en 1889 à Strasbourg, lorsque son assistant lui a signalé que les chiens opérés la veille avaient soif et que leurs urines attiraient les mouches… La destruction des îlots de Langerhans a été identifiée peu après, chez le diabétique[6]. Les travaux des physiologistes du début du XXe siècle, influencés par Claude Bernard, ont permis d'établir le concept de sécrétion par le pancréas d'une substance permettant de réguler l'utilisation du glucose. Plusieurs chercheurs ont préparé des extraits de pancréas dans le but de purifier un extrait qui pourrait avoir une utilité thérapeutique chez les diabétiques. Nicolae Paulescu a été un précurseur important, mais ses préparations peu purifiées n'étaient pas utilisables. Les meilleurs extraits ont été préparés par Frederick Grant Banting avec l'aide de Charles Best, un étudiant en médecine, dans le laboratoire de John James Rickard Macleod au cours de l'été 1921 à Toronto. Le premier produit, préparé par Banting et Best, peu actif et très impur, a ouvert la voie au traitement du diabète grâce au travail magistral et ultra-rapide de J. B. Collip, un biochimiste, qui a, en quelques semaines, préparé un extrait relativement pur et utilisable à fins thérapeutiques. Il est testé chez l'être humain pour la première fois en 1922[7]. Banting et Macleod ont été, dès 1923, les lauréats du Prix Nobel de physiologie et de médecine, récompensant leurs travaux.
L'histoire a retenu le nom du premier diabétique ayant reçu les préparations de Banting et Best, puis celle purifiée par Collip : le , Léonard Thompson, un adolescent de 14 ans, sur le point de mourir à l'hôpital général de Toronto (en), reçoit une première injection qui fera baisser un peu et très transitoirement la glycémie, et sera suivie d'un abcès au point d'injection, dû aux impuretés de la préparation[8]. Quelques jours plus tard, l'injection d'un produit plus pur a des effets indiscutables sur la glycémie et les symptômes : l'efficacité de l'hormone venait d'être prouvée chez l'être humain.
Les premières insulines étaient purifiées à partir de pancréas de bœuf et de porc. Dans les années 1930, diverses préparations ont permis d'obtenir des formes d'action prolongée de l'insuline par cristallisation en présence de zinc, ou prolongation de temps de résorption sous la peau par l'adjonction de protamine (insuline NPH, préparée par Hagedorn).
Depuis le début des années 1980, les insulines sont synthétisées par des organismes génétiquement modifiés. La plupart des pays ont ainsi abandonné la préparation d'insuline à partir de pancréas de bœuf dans les suites de la maladie de la vache folle, quoiqu'aucun cas de transmission de virus ou prion par l'insuline n'ait jamais été observé.
Mode d'action
Les lieux de stockage du glucose sont les muscles, le tissu adipeux et le foie. En cas d'abondance alimentaire, l'insuline stimule aussi la conversion des glucides en acides gras, en vue de leur stockage dans le tissu adipeux. Dans cette situation d'abondance alimentaire, après les repas, l'insuline bloque la production de glucose par le foie. Par la mise en stock du glucose alimentaire et l'arrêt de la production de glucose par le foie, la glycémie baisse. À distance des repas, la baisse de la sécrétion de l'insuline permet la libération des stocks de glucose (glycogénolyse du foie) et la production de novo de glucose par le foie (néoglucogenèse). Cette production de novo de glucose par le foie ne peut se prolonger car elle utilise directement les muscles, plutôt que les réserves énergétiques quantitativement bien plus importantes du tissu adipeux.
Lors du jeûne prolongé (au-delà de quelques jours chez l'adulte, mais seulement quelques heures chez le nouveau-né et le nourrisson), la poursuite de la baisse de l'insuline permet la production des corps cétoniques, ce qui permet l'épargne musculaire, car les corps cétoniques sont dérivés des acides gras du tissu adipeux. L'insuline a par ailleurs des effets importants sur le métabolisme des protéines : elle inhibe la dégradation des protéines et favorise la captation des acides aminés. Enfin, elle inhibe la lipolyse et favorise la lipogenèse, c'est-à-dire la fabrication de triglycérides à partir d'acides gras. En résumé, l'insuline est aussi l'hormone qui permet le stockage de graisses.
Au-delà de son effet immédiat sur la régulation des flux de substrats, l'insuline a des effets à plus long terme sur la croissance ; c'est une hormone anabolisante. Il est ici intéressant de souligner la forte homologie entre l'insuline et le principal facteur de la croissance, l’insulin-like growth factor (IGF-1), ou « facteur de croissance similaire à l'insuline ». L'insuline en tant que molécule de signalisation de la présence d'aliments dans le tube digestif peut être assimilée à une hormone de l'abondance, signalant le surplus énergétique permettant la croissance. L'insuline a des effets anabolisants directs, par son action sur les métabolismes des glucides, protéines et lipides, mais aussi indirects, par la régulation des protéines porteuses de l'IGF-1.
Structure et production
| Préproinsuline | ||
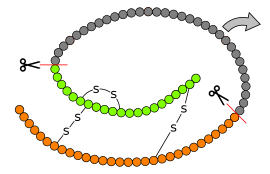 Formation de l'insuline à partir de la proinsuline. La préproinsuline est le produit de l'expression du gène INS et compte 110 résidus d'acides aminés. L'élimination des 24 résidus C-terminaux formant le peptide signal au niveau du réticulum endoplasmique donne la proinsuline, laquelle est convertie en insuline par élimination de 35 résidus entre les chaînes A et B, elles-mêmes réticulées par ponts disulfures. | ||
| Caractéristiques générales | ||
|---|---|---|
| Symbole | INS | |
| Homo sapiens | ||
| Locus | 11p15.5 | |
| Masse moléculaire | 11 981 Da[9] | |
| Nombre de résidus | 110 acides aminés[9] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
L'insuline est une hormone constituée de 2 chaînes polypeptidiques reliées entre elles par 2 ponts disulfures et 1 pont disulfure intrachaîne dans la chaine A : une chaîne A de 21 acides aminés, et une chaîne B de 30 acides aminés. La structure de l'insuline a été déterminée par Frederick Sanger. Ce fut l'objet du premier de ses deux prix Nobel, en 1958. L'insuline est produite par les cellules β des îlots de Langerhans du pancréas sous la forme d'une pré-pro-insuline constituée d'une seule chaîne peptidique, dont deux fragments, le peptide signal (23AA N-ter) est éliminé par l'action d'une enzyme, la signal peptidase qui va cliver le peptide signal entraînant la création des trois ponts disulfures, on obtient la pro-insuline qui subira l'élimination du peptide C par une autre enzyme, la PC1, ce qui va libérer un fragment central, tandis que les deux chaînes néoformées vont rester associées grâce aux ponts disulfures : enfin l'extrémité C-Terminale d'une des chaines va être clivée par l'action d'une carboxypeptidase E (CPE) pour devenir l'insuline sous sa forme mature, et donc active. La proinsuline a une structure très voisine de celle des deux principaux facteurs de croissance, IGF-1 et IGF-2, et des concentrations élevées de ces hormones permettent des effets biologiques par signalisation après liaison aux récepteurs des autres : hypoglycémie lors de sécrétion massive d'IGF-1 et d'IGF-2 par des tumeurs. L'insuline circule à des concentrations de l'ordre de la nanomole par litre.
Dans chaque cellule β l'insuline est synthétisée dans le réticulum endoplasmique puis modifiée par l'appareil de Golgi avant d'être libérée par exocytose et de passer dans le sang.
Stimulation de la sécrétion
Le glucose sanguin filtre à travers le capillaire dans le liquide interstitiel qui baigne les cellules β des îlots de Langerhans. La concentration de glucose autour des cellules β est donc la même que dans le sang. La cellule importe le glucose par un transporteur non saturable GLUT2 (les autres cellules du corps ont un récepteur rapidement saturé). La concentration de glucose intracellulaire reflète donc celle du sang. L'entrée du glucose dans la cellule bêta est immédiatement suivie de sa phosphorylation par une hexokinase spécifique, la glucokinase, dont les caractéristiques cinétiques jouent un rôle important dans le couplage glycémie/insulinosécrétion (la perte de 50 % de l'activité de la glucokinase est la cause d'une forme particulière de diabète, le MODY-2). Le métabolisme du glucose dans la cellule β augmente le rapport ATP/ADP. Cela induit la fermeture d'un canal potassique sensible à cette augmentation de la quantité d'ATP. Si les ions K+ (potassium) cessent de sortir, cela dépolarise la cellule β qui est une cellule excitable puisqu'elle a une activité électrique dès que les concentrations en glucose extracellulaire dépassent 5 mmol·L-1. Cette dépolarisation ouvre des canaux calciques sensibles au voltage : le calcium entre dans la cellule et déclenche l'exocytose des vésicules contenant de l'insuline.
En tant que médication

Modes d'administration
L'insuline est administrée soit en continu par perfusion intraveineuse ou sous-cutanée (par l'intermédiaire d'une pompe à insuline), soit en discontinu par une ou plusieurs injections quotidiennes sous-cutanées, ce qui apparaît comme une contrainte pénible à de nombreux patients.
Dosage et délais
Cela dépend de la personne, de son poids, de sa taille et d'autres éléments.
Types
On distingue classiquement les insulines suivant leur délai et leur durée d'action : « rapide », « lente » et « semi-lente » ou des « mix » rapides et semi-lentes.
L'allongement du délai d'action se fait essentiellement par adjonction de zinc ou de protamine dans la solution d'insuline, permettant la formation de cristaux ou de précipités dont la diffusion vers le sang est beaucoup plus lente.
Les préparations modernes d'insuline font appel à des molécules analogues de l'insuline, dont l'efficacité a été conservée mais dont la cinétique de résorption est modifiée. On dispose ainsi d'analogues dont la vitesse de passage du tissu sous-cutané vers le sang est accélérée (analogue « ultrarapide », dont la lispro (en), l'aspart (en) et la glulisine (en)), et d'analogues dont la vitesse de résorption est réduite par précipitation dans le tissu sous-cutané, que ce soit en présence de zinc (analogue détémir (en)) ou par modification du point isoélectrique (analogue glargine (en)).
Abus
L'insuline paraît être utilisée comme dopage par des sportifs de disciplines diverses[10],[11] dont les cyclistes et les culturistes. Cette technique est cependant hautement dangereuse, car elle peut exposer à une hypoglycémie dont les conséquences peuvent être sévères[11] et, à long terme, elle peut provoquer un diabète de type 2, voire la mort.
En football, l'insuline fut massivement employée dans les équipes espagnoles au cours des années 1990 et au début des années 2000, sans jamais qu'aucun joueur ne soit pris, faute de contrôles sérieux[12]. En cyclisme, Marco Pantani fut lui aussi testé positif à cette substance en 2002[13]. Le culturisme est aussi une activité où l'emploi détourné d'insuline est présent[14].
À l'inverse, un défaut intentionnel d'insuline pour une personne insulino-dépendante entraîne une perte de poids, mais qui ne va pas sans conséquences sur sa santé dans son ensemble (notamment hyperglycémie, augmentation des corps cétoniques). Ce comportement est généralement appelé "diaboulimie"[15],[16].
Conservation
L'insuline est assez résistante mais reste un produit biologique dont la qualité peut se dégrader dans le temps ou du fait d'une forte chaleur ou du froid, quelle que soit sa forme (flacon, cartouches, stylos ou pistolets injecteurs d'insuline, pompes).
L'insuline non entamée doit être conservée au réfrigérateur de préférence dans le bac à légumes, mais en aucun cas dans un congélateur dont la température inférieure à 0 °C détruirait de façon irréversible[Comment ?] les propriétés hypoglycémiantes de l'insuline.
L'insuline entamée peut être conservée à température ambiante plusieurs semaines. Comme l'insuline non entamée, elle ne doit jamais être mise en contact avec des températures inférieures à 0 °C. Par ailleurs, des températures supérieures à 25 °C - 30 °C ou une exposition à la lumière peuvent réduire un peu l'efficacité de l'insuline. En 2017, il n'existe pas d'indicateur de péremption autre que la date mentionnée sur le stylo piqueur, qui n'est valable que si l'insuline a été conservée à température fraîche.
Agrégation
L'insuline est l'une des 20 protéines humaines connues pour pouvoir former des fibres amyloïdes in vitro. La formation de ces fibres est principalement liée au pH, à la température et à la surface des matériaux auxquels l'insuline est exposée[17].
Bien que l'agrégation amyloïde de l'insuline n'ait jamais été observée in vivo chez l'humain, des dépôts localisés de fibres amyloïdes d'insuline ont été observés près du site d'injection chez des patients diabétiques[18]. La formulation de l'insuline thérapeutique permet de réduire son agrégation.
L’agrégation de l'insuline in vivo existe néanmoins chez d'autres mammifères, des rongeurs Cavimorphes chez qui la structure de l'insuline est différente[19]. Octodon degus en particulier est utilisé comme organisme modèle pour l'étude du diabète.
Cure de Sakel
L'insuline fut utilisée comme traitement psychiatrique de choc : expérimentée autour de 1933, en Autriche, puis en France, cette cure dite « choc insulinique » ou « cure de Sakel » (d'après le nom de son inventeur, le Dr Manfred Sakel), fut proposée en France dès l’année 1936, et reprise après la Seconde Guerre mondiale. Le traitement fut rendu obsolète par l'arrivée (en 1952 en France) des psychotropes[20].
Divers
L'insuline fait partie de la liste des médicaments essentiels de l'Organisation mondiale de la santé (liste mise à jour en avril 2013)[21].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) James R. Wright Jr, Hua Yang, Olga Hyrtsenko, Bao-You Xu, Zeiming Yu et Bill Pohajdak, « A review of piscine islet xenotransplantation using wild-type tilapia donors and the production of transgenic tilapia expressing a “humanized” tilapia insulin », Xenotransplantation, vol. 21, no 6, , p. 485-495 (PMID 25040337, PMCID 4283710, DOI 10.1111/xen.12115, lire en ligne).
- (en) P. Sonksen et J. Sonksen, « Insulin: understanding its action in health and disease », British Journal of Anaesthesia, vol. 85, no 1, , p. 69-79 (PMID 10927996, DOI 10.1093/bja/85.1.69, lire en ligne).
- (de) von Mering J. Minkowski O. « Diabetes mellitus nach Pankreasextirpation » Archiv Exp Pathol Pharmacol. 1890;26:371–87.
- Pdt. Jacques Mirouze, « Une histoire ininterrompue : la découverte de l'insuline », Histoire des sciences médicales, Asnières, Les éditions de médecine pratique, vol. XVIII, no 1, , p. 85/96 (présentation en ligne, lire en ligne [PDF], consulté le 16 décembre 2018) (consulté le 16 décembre 2018)
- (en) Opie E. « On the relation of chronic interstitial pancreatitis to the islands of Langerhans and to diabetes mellitus » J Exp Med. 1901;5:397–428. .
- (en) Banting FG, Best C, Collip J, Campbell W, Fletcher A. « Pancreatic extracts in the treatment of diabetes mellitus » Can Med Assoc J. 1922;12:141–6.
- (en) Bliss M, « Rewriting medical history: Charles Best and the Banting and Best myth », J Hist Med Allied Sci., vol. 48, no 3, , p. 253–74 (PMID 8409364, lire en ligne).
- Les valeurs de la masse et du nombre de résidus indiquées ici sont celles du précurseur protéique issu de la traduction du gène, avant modifications post-traductionnelles, et peuvent différer significativement des valeurs correspondantes pour la protéine fonctionnelle.
- (en) PH Sonksen, « Insulin, growth hormone and sport », J Endocrinol, vol. 170, no 1, , p. 13-25. (PMID 11431133, lire en ligne [PDF])
- (en) Holt RI, Sönksen PH, « Growth hormone, IGF-I and insulin and their abuse in sport », Br J Pharmacol, vol. 154, no 3, , p. 542-56. (PMID 18376417, PMCID PMC2439509, DOI 10.1038/bjp.2008.99, lire en ligne [html]).
- Le Real Madrid et le Barça liés au docteur Fuentes - www.footballistique.com du - consulté le 20 juillet 2011
- Dopage Pantani rattrapé par l'insuline - www.libération.fr du 4/5/2002 - consulté le 20 juillet 2011.
- Après la chasse à la CERA celle à l'insuline, www.20min.ch du 14 octobre 2008 - consulté le 20 juillet 2011.
- Diaboulimie - FRDJ - frdj.ca
- "Diaboulimie" : Des diabétiques se privent d’insuline pour maigrir - doctissimo.fr, le
- Nault, L., Guo, P., Jain, B., Bréchet, Y., Bruckert, F., & Weidenhaupt, M. (2013). Human insulin adsorption kinetics, conformational changes and amyloidal aggregate formation on hydrophobic surfaces. Acta biomaterialia, 9(2), 5070–9. doi:10.1016/j.actbio.2012.09.025.
- Swift, B., & Hawkins, P. (2002). Examination of insulin injection sites: an unexpected finding of localized amyloidosis. Diabetic medicine, 881–886. Retrieved from http://onlinelibrary.wiley.com/doi/10.1046/j.1464-5491.2002.07581.x/abstract.
- Opazo, J. C., Palma, R. E., Melo, F., & Lessa, E. P. (2005). Adaptive evolution of the insulin gene in caviomorph rodents. Molecular biology and evolution, 22(5), 1290-1298.
- http://www.serpsy.org/piste_recherche/choc/masseix_choc.html
- (en) WHO Model List of Essential Medicines, 18th list, avril 2013.
Voir aussi
Bibliographie
- Beaumont, Physiologie animale Dunod, Rieutort médecine-sciences
Articles connexes
Anatomie et physiologie
Maladies
Traitements
Liens externes
- Portail de la médecine
- Portail de la pharmacie
- Portail de la biochimie
- Portail de la chimie