आदर्श गैस समीकरण
आदर्श गैस समीकरण, आदर्श गैस के आयतन, दाब एवं ताप के अन्तर्सम्बन्धों को व्यक्त करने वाला समीकरण है। इसे सर्वप्रथम सन १८३४ में बेन्वायट पॉल एमाइल क्लैपिरोन (Benoît Paul Émile Clapeyron) ने प्रकाशित किया था।
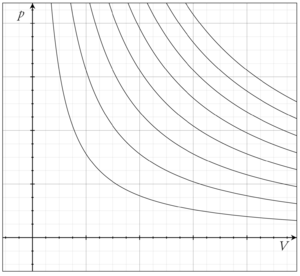
किसी गैस का समतापी प्रक्रम : अलग-अलग नियत तापों पर गैस के आयतन और दाब के बीच सम्बन्ध
आदर्श गैस का समीकरण निम्नवत है:
जहाँ
- गैस का (निरपेक्ष) दाब है
- गैस का आयतन है
- गैस के मोलों की संख्या है
- सार्वत्रिक गैस नियतांक (universal gas constant) है,
- परम ताप (absolute temperature) है।
सार्वत्रिक गैस नियतांक, R, का मान मापन की विभिन्न इकाइयों में नीचे दिया गया है।
R = 8.315472 J·mol−1·K−1 = 8.314472 m3·Pa·K−1·mol−1 = 8.314472 kPa·L·mol−1·K−1 = 0.08205784 L·atm·K−1·mol−1 = 62.3637 L·mmHg·K−1·mol−1 = 10.7316 ft3·psi·°R−1·lb-mol−1 = 53.34 ft·lbf·°R−1·lbm−1 (for air)
इन्हें भी देखें
This article is issued from
Wikipedia.
The text is licensed under Creative
Commons - Attribution - Sharealike.
Additional terms may apply for the media files.